שגשוג תאי
שגשוג תאי הוא התהליך שבו תא גדל ומתחלק לייצור שני תאי בת.[1][2][3][4] שגשוג מתמשך של תאים מוביל לעלייה אקספוננציאלית במספר התאים ולכן זהו מנגנון מהיר לצמיחת רקמות. שגשוג תאי מחייב שגם גדילת התאים (אנ') וגם חלוקה (רבייה) של התאים תתרחשנה במקביל, כך שהגודל הממוצע של התאים נשאר קבוע.
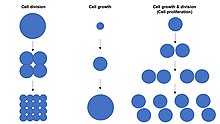
להבדיל, חלוקת תאים יכולה להתרחש ללא גדילת תאים, כך שנוצרים תאים קטנים יותר ויותר בהדרגה (כמו בחלוקת הזיגוטה). כמו כן, גדילת תאים יכולה להתרחש ללא חלוקת תאים כדי לייצר תא אחד גדול יותר (כמו בצמיחה של נוירונים). לפיכך, שגשוג תאי איננו שם נרדף לגדילת תאים או לחלוקת תאים, למרות שלעיתים משתמשים במונחים אלה בערבוביה.[5]
תאי גזע עוברים שגשוג תאי ויוצרים תאי בת משגשגים, שמתמיינים מאוחר יותר לבניית רקמות. תהליכים אלו מתרחשים במהלך התפתחות תקינה וצמיחת רקמות, במהלך התחדשות רקמות לאחר נזק,[6] או בתהליך סרטני.[7]
המספר הכולל של תאים באוכלוסייה תלוי בהפרש בין קצב שגשוג (או חלוקת) התאים לבין קצב התמותה של התאים.
גודל התא תלוי הן בגדילת תאים והן בחלוקת תאים, כאשר עלייה לא מידתית בקצב גדילת התאים מובילה להיווצרות תאים גדולים יותר ועלייה לא מידתית בקצב חלוקת התאים מביאה להיווצרות תאים קטנים יותר. שגשוג תאי כרוך, בדרך כלל, בגדילת תאים מאוזנת וקצבי חלוקת תאים השומרים על גודל תאים קבוע פחות או יותר, באוכלוסיית התאים המתרבה באופן מעריכי. בקרה של איזון זה מבוצעת במידה רבה על ידי גורמי שעתוק.
בחד-תאיים, שגשוג התאים מגיב במידה רבה לזמינות של חומרים מזינים בסביבה (או במצע גידול מעבדתי).
באאוקריוטים בקרת השגשוג מתרחשת על ידי שילוב של גדילת התאים עם בקרה של מחזורי התא ("G1-S-M-G2") כדי ליצור צאצאים רבים של תאים דיפלואידיים.
בהתפתחות של רב-תאיים, שגשוג התאים נשלט באופן הדוק על ידי רשתות בקרת גנים המקודדות בגנום. אלו מופעלות בהתאם למיקום התא, כיוונו ביחס לתאים האחרים וכוחות מכניים המופעלים עליו. רשתות אלו כוללות גורמי גדילה ויוצרות מסלולי הולכת אותות הפועלים על ידי תקשורת בין תאים, גורמי שיעתוק ומיקרו-RNA.[4] נמצא גם, שהתצמיד החלבוני mTORC1 מווסת כניסת ביקרבונט לתא, הדרושה ליצירת נוקלאוטידים ולחלוקת התא.[8]
אכילת מזון גורמת להפרשת הורמונים ממשפחת האינסולין / IGF-1 (גם הם גורמי גדילה) למחזור הדם, ולקדם שגשוג תאים ברקמות רבות.
שגשוג תאים בלתי מבוקר, המוביל לקצב שגשוג מוגבר, או לכישלון בעצירת שגשוג התאים במועד התקין, הוא גורם להיפרפלזיה [9] ולסרטן.[10]
קישורים חיצוניים
עריכההערות שוליים
עריכה- ^ I. Conlon, M. Raff, Size control in animal development, Cell 96, 1999-01-22, עמ' 235–244 doi: 10.1016/s0092-8674(00)80563-2 (באנגלית)
- ^ Savraj S. Grewal, Bruce A. Edgar, Controlling cell division in yeast and animals: does size matter?, Journal of Biology 2, 2003, עמ' 5 doi: 10.1186/1475-4924-2-5 (באנגלית)
- ^ T. P. Neufeld, A. F. de la Cruz, L. A. Johnston, B. A. Edgar, Coordination of growth and cell division in the Drosophila wing, Cell 93, 1998-06-26, עמ' 1183–1193 doi: 10.1016/s0092-8674(00)81462-2 (באנגלית)
- ^ 1 2 Barry J. Thompson, Developmental control of cell growth and division in Drosophila, Current Opinion in Cell Biology 22, 2010-12, עמ' 788–794 doi: 10.1016/j.ceb.2010.08.018 (באנגלית)
- ^ Leslie J. Saucedo, Bruce A. Edgar, Why size matters: altering cell size, Current Opinion in Genetics & Development 12, 2002-10, עמ' 565–571 doi: 10.1016/s0959-437x(02)00341-6 (באנגלית)
- ^ Giovanni Ligresti, Ahmed A. Raslan, Jeongmin Hong, Nunzia Caporarello, Marco Confalonieri, Steven K. Huang, Mesenchymal cells in the Lung: Evolving concepts and their role in fibrosis, Gene 859, 2023-04-05, עמ' 147142 doi: 10.1016/j.gene.2022.147142 (באנגלית)
- ^ W. A. Robinson, Current concepts of abnormal stem cell proliferation in human disease, Acta Haematologica 62, 1979, עמ' 331–337 doi: 10.1159/000207598 (באנגלית)
- ^ Eunus S. Ali, Anna Lipońska, Brendan P. O'Hara, David R. Amici, Michael D. Torno, Peng Gao, John M. Asara, Mee-Ngan F. Yap, Marc L. Mendillo, Issam Ben-Sahra, The mTORC1-SLC4A7 axis stimulates bicarbonate import to enhance de novo nucleotide synthesis, Molecular Cell 82, 2022-09-01, עמ' 3284–3298.e7 doi: 10.1016/j.molcel.2022.06.008 (באנגלית)
- ^ אדי קרניאלי, הערכת סיכונים ותועלת בשימוש בליראגלוטיד - סקירת ה־FDA, הרפואה update | סוכרת, [ההסתדרות הרפואית בישראל]
- ^ Sofie Björner, Paul A. Fitzpatrick, Yaoyong Li, Craig Allred, Anthony Howell, Anita Ringberg, Håkan Olsson, Crispin J. Miller, Håkan Axelson, Göran Landberg, Epithelial and stromal microRNA signatures of columnar cell hyperplasia linking Let-7c to precancerous and cancerous breast cancer cell proliferation, PloS One 9, 2014, עמ' e105099 doi: 10.1371/journal.pone.0105099 (באנגלית)