קנה (ראייה)
קנה[1] (Rod cell) הוא סוג של תא קולט אור שנמצא ברשתית העין, ויכול לפעול באור בעוצמה חלשה ביחס לתאים קולטי האור האחרים, המדוכים.[2] תאים אלה קולטים פוטונים וממירים אותם לאות חשמלי שעובר לתאי רשתית דו-קוטביים, ומשם לתאי גנגליון ואל המוח.[3] הקנים ממוקמים בחלקה החיצוני של הרשתית.[4] כיוון שתאים אלה רגישים יותר לאור, הם התאים העיקריים שמשמשים לראיית לילה. לאדם בממוצע יש כ-90 מיליון קנים בכל רשתית.[4]
 | |
| מבנה של תא קנה | |
| שיוך |
vertebrate photoreceptor cells, neuron of retina |
|---|---|
| מיקום אנטומי |
רשתית |
| מוליך עצבי |
חומצה גלוטמית |
| תפקיד נוירולוגי |
גלאי אור |
| קישור סינפטי | תא דו-קוטבי, תא אופקי |
| מזהים | |
| טרמינולוגיה היסטולוגיקה |
H3.11.08.3.01030 |
| מזהה נרולוקס |
nlx_cell_100212 |
| FMA |
67747 |
| קוד MeSH |
A08.675.650.850.625.670.650 |
| מזהה MeSH |
D017948 |
| מערכת השפה הרפואית המאוחדת |
C0206427 |
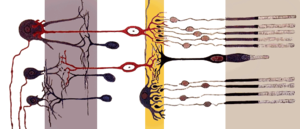
הקנים ארוכים יותר מהמדוכים, על אף שמבנם הכללי דומה. קצה התא כולל דיסקיות רבות ובהן רודופסין, חלבון שמשמש לקליטה של פוטונים והמרתם לאות כימי.[4] הדיסקיות קולטות אורכי גל שונים, ולכן רגישותם לאור גבוהה יותר. הקנים יכולים להעביר מידע על נוכחות או היעדר אור, אך אינם מספקים מידע לגבי צבעים וזאת באמצעות קליטת אורכי הגל השונים.[4] רגישותם לפוטונים גבוהה בהרבה משל מדוכים, והם מגיבים בנוכחות של פוטונים בודדים.[5][2]
בניגוד למדוכים, כל כמה קנים מקושרים לנוירון ביניים (interneuron) אחד, שקולט ומגביר את המידע. הקנים מגיבים לאט יותר מהמדוכים, עובדה הגורמת להסתגלות איטית יחסית לאור.[2]

ניסויים שערך ג'ורג' וולד הראו כי הרגישות הגבוהה ביותר של קנים היא לאורך גל של כ-498 ננומטרים (צבע ירוק-כחול)[6] וכי הם אינם מגיבים לאורכי גל העולים על 640 ננומטרים (אדום).[2] עובדה זו קשורה לאפקט פורקינייה (Purkinje effect), שלפיו בשעות הדמדומים הקנים הולכים ונהיים דומיננטיים יותר בראייה, ולכן בטרם נעלם הצבע לחלוטין, יכולת הראייה נעה לכיוון שיא הרגישות של הקנים (ירוק-כחול).[2]
תגובה לאור
עריכהבבעלי חוליות, השפעול של התאים קולטי האור בתגובה לאור הוא היפר-פולריזציה, כלומר הורדת המתח מתחת לסף פוטנציאל הפעולה. בחושך, התאים עוברים דה-פולריזציה, כלומר העלאת המתח מעל סף פוטנציאל הפעולה, ומשחררים נוירוטרנסמיטר, אשר עושה היפר-פולריזציה לתאים הדו-קוטביים וכך מדכאים את פעילותם.[7] כתוצאה מכך שהתאים הדו-קוטביים עוברים היפר-פולריזציה, הם אינם מעבירים נוירוטרנסמיטר לגנגליון הראייה, וכך לא עובר אות הלאה. כשמגיע פוטון ונקלט ברודופסין, הקנים עוברים היפר-פולריזציה ועל כן מפסיקים את עיכוב התאים הדו-קוטביים ולכן אות עובר לגנגליון ומשם למערכת העצבים.
התגובה בחושך מתרחשת הודות לריכוז גבוה של cGMP בתא המוביל לפתיחה של תעלות יוניות המעבירות נתרן וסידן.[7] כניסת היונים החיוביים גורמת לדה-פולריזציה וכתוצאה מכך לשחרור של הנוירוטרנסמיטר חומצה גלוטמית, הגורם להיפר-פולריזציה בתאים הדו-קוטביים. באור, 11-cis-retinal של הרודופסין עובר ממצב זה לקונפורמציה לטראנס, הגורם לשינוי המבנה של האופסין. שינוי מבני זה גורם להפעלה של חלבון ה-G טראנסדיוסין (Transducin) הגורם להפעלה של cGMP פוספודיאסטראז (cGMP PDE), השובר cGMP ל-5'GMP. כתוצאה מכך, יש ירידה בריכוז ה-cGMP בתא והתעלות שמעבירות נתרן וסידן נסגרות. כתוצאה מכך יש היפר-פולריזציה של התא והנוירוטרנסמיטר אינו עובר לתאים הדו-קוטביים.
הרטינל המשמש את הקנים מקורו בוויטמין A. פגיעה באנזים גורמת לפגיעה ברגישות לאור וכך לעיוורון לילה.
חזרה למצב הלא פעיל
עריכהבקנים קיימים שלושה משובים שליליים המאפשרים חזרה למצב מנוחה, קינאזות, GTPase ויצירה מחדש של cGMP. קינאזות שהם רודופסין קינאזות (rhodopsin kinase), כגון GRK[8] מסוג β-adrenergic receptor kinase (βARK),[9] מזרחנים את הרודופסין בקצה הקרבוקסילי ובכך מעכבים באופן חלקי את הטראנסדיוסין. כשהקצה מזורחן, ארסטין (arrestin) יכול להיקשר אליו להפסקה סופית של הפעילות באמצעות הפרעה פיזית לקישור הטראנסדיוסין. במקביל, חלבון בקרה נוסף נכנס לפעולה, ה-GTPase-activating proteins (GTPase), שגורם להחלפת ה-GTP בטראנסדיוסין ל-GDP ובכך עוצר את פעילותו.[10]
כמו כן, הירידה בריכוז הסידן, שנובעת מסגירת התעלות תלויות ה-cGMP שמכניסות בחושך נתרן וסידן, גורמות להפעלה של גואניליל ציקלאז (guanylyl cyclase) ובכך ליצירה מחדש של ה-cGMP. החזרת ריכוז ה-cGMP בתא גורם לפתיחה מחדש של תעלות הנתרן-סידן ולדה-פולריזציה של התא.[7]
כשקנים חשופים זמן ארוך לאור, קיימת אפשרות להסתגל לסביבה, מנגנון שקורה באמצעות ביטול זמני של הרגישות לאור (Desensitization). המנגנון מתרחש בעת קשירה של ארסטין לרודופסין, והוא משמש כמגשר בין הרודופסין לחלבון Clathrin, בתהליך שמכונה clathrin-dependent endocytosis. קיימות כמה דרכים לביטול הרגישות. הראשונה היא בידוד (sequestration) הרודופסין, כלומר הכנסה שלו באנדוציטוזה לתוך אנדוזום או ליזוזום ובכך להפסקת הפעילות.[11][12]
קישורים חיצוניים
עריכה- על הרשתית ושם פירוט על הקנים ב-Springfield Technical Community College
- H. Gobind Khorana, Rhodopsin, Photoreceptor of the Rod Cell, The journal of biological chemistry, 1992
- Cyclic Pathway of Rhodopsin and its Relationship to Hyperpolarization of the Rod, באתר The vertebrate eye מאת ד"ר תומאס קאקקי ( Dr. Thomas Caceci)
- קנה, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
עריכה- ^ אין להתבלבל עם cones-מדוך בעברית שהם למעשה הסוג השני של התאים קולטי אור בעין
- ^ 1 2 3 4 5 Cone Details, Georgia State University
- ^ JF Ashmore, G Falk, Responses of rod-bipolar cells in the dark-adapted retina of the dogfish, Scyliorhinus canicula, The Journal of physiology, 1980
- ^ 1 2 3 4 CHRISTINE A. CURCIO, KENNETH R. SLOAN, ROBERT E. KALINA, AND ANITA E. HENDRICKSON, Human Photoreceptor Topography, WILEY-LISS, INC., 1990
- ^ Haruhisa; Alapakkam P. Sampath, Optimization of Single-Photon Response Transmission at the Rod-to-Rod Bipolar Synapse, Physiology (Int. Union Physiol. Sci./Am. Physiol. Soc.) 22 (4): 279–286.
- ^ RG Foster, MW Hankins, Progress in retinal and eye research, Elsevier, 2002
- ^ 1 2 3 H Okawa, AP Sampath, SB Laughlin, GL Fain, ATP Consumption by Mammalian Rod Photoreceptors in Darkness and in Light, Current Biology, 2008
- ^ TRUDY A. KOHOUT and ROBERT J. LEFKOWITZ, Regulation of G Protein-Coupled Receptor Kinases and Arrestins During Receptor Desensitization, Molecular pharmacology, 2003
- ^ ,M J Lohse, S Andexinger, J Pitcher, S Trukawinski, J Codina, J P Faure, M G Caron and R J Lefkowitz, Receptor-specific desensitization with purified proteins. Kinase dependence and receptor specificity of beta-arrestin and arrestin in the beta 2-adrenergic receptor and rhodopsin systems, Journal of Biological, 1992
- ^ Neuron 20, 11-14 (1999)
- ^ Blakeley LR, Chen C, Chen CK, Chen J, Crouch RK, Travis GH, Koutalos Y., Rod outer segment retinol formation is independent of Abca4, arrestin, rhodopsin kinase, and rhodopsin palmitylation, Invest Ophthalmol Vis Sci., 2011
- ^ P T Campbell, M Hnatowich, B F O'Dowd, M G Caron, R J Lefkowitz and W P Hausdorff, Mutations of the human beta 2-adrenergic receptor that impair coupling to Gs interfere with receptor down-regulation but not sequestration, Molecular pharmacology, 1991