אופסין
אופסין הוא חלבון ממברנלי ממשפחת הקולטנים המצומדים לחלבוני G המשמש כקולטן עצבי רגיש לאור ביצורים חיים (פוטורצפטור). נכון לשנת 2005, זוהו למעלה מאלף אופסינים שונים[1], שישה מתוכם זוהו בתאים קולטי אור ברשתית העין האנושית. כל האופסינים מכילים קבוצה פונקציונלית בשם רטינל, נגזרת כימית של ויטמין A, הרגישה לאור.
 | |
| שיוך |
G protein-coupled receptor, rhodopsin-like |
|---|---|
| מזהים | |
| קוד MeSH |
D12.776.306.466 |
| מזהה MeSH |
D055355 |
| מערכת השפה הרפואית המאוחדת |
C2355587 |

ישנן שתי קבוצות של אופסינים שאינן הומולוגיות זו לזו, אך הן בעלות תפקוד ומבנה דומה. אופסינים מטיפוס I מצויים בפרוקריוטים, בעוד אופסינים מטיפוס II נמצאים בבעלי חיים. לא ידוע על קיום אופסינים בקבוצות אחרות של אורגניזמים כגון צמחים ופטריות.
אופסינים מטיפוס I
עריכהאופסינים מטיפוס II
עריכהניתן לסווג את האופסינים מטיפוס II לשש קבוצות נבדלות על פי רצף חומצות האמינו שלהם. קבוצות אלו חולקות ביניהן פחות מ-20% מרצפי החלבון.
אופסינים ברשתית העין האנושית
עריכההרשתית האנושית מכילה מערך צפוף של תאים קולטי-אור, המסווגים לפי האופסינים שהם מכילים:
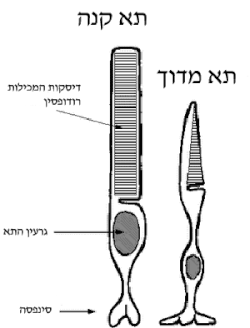
- רודופסין - קולטן המצוי בתאי קנים, המסייעים במיוחד בתנאי תאורה לקויה.
- פוטופסינים - ארבעה קולטנים שונים המצויים בתאי מדוכים, המסייעים להבדלה בין צבעים שונים.
- מלאנופסין - קולטן המצוי בתאי גנגליון קולטי אור ברשתית, המסייעים להתאמת קוטר האישון והמקצב היממי של השעון הביולוגי לרמות התאורה השוררות בסביבה[2].
המונח קולט אור (פוטורצפטור) משמש בערבוביה הן עבור הקולטנים העצביים הרגישים לאור והן עבור תאי הרשתית המכילים אותם - קנים, מדוכים ותאי גנגליון רגישי-אור. תאים קולטי אור נבדלים מתאי עצב אחרים במתח החשמלי הנשמר על פני קרומם. מרבית סוגי תאי העצב שומרים על מתח מנוחה של כ־70- מיליוולט, אשר עשוי לנסוק לכ־50+ מיליוולט בהשפעת גירויים שונים. לעומת זאת, תאים קולטי אור שומרים על מתח מנוחה גבוה יותר, שדי בו לחולל דחפים עצביים באופן שוטף. מתח המנוחה פוחת בהשפעת סדרת תגובות שמתניעה בליעת הפוטון באופסין, כך שלקליטת האור השפעה מעכבת על פעילותם העצבית של תאים קולטי אור. גם מערכת השמיעה נשענת על משטר ממתחים חשמליים חריגים בקולטנים שבאיבר קורטי ותכונה זו עשויה לתרום לרגישות מערכות חושיות אלה.
רודופסין
עריכההרודופסין מצוי בתאי הקנה שברשתית. הוא מורכב מהחלבון סקוטופסין הקשור קוולנטית למולקולת רטינל הנמצאת במרכזו. מולקולת הרטינל מתפקדת ככרומופור וגורמת לשינוי מבני בסקוטופסין בתגובה לקליטת פוטון. שינוי מבני זה מפעיל את החלבון טרנסדיוצין אשר מעביר את האות הלאה בתא הקנה וממנו למרכז הראיה במוח. חלבון הרודופסין משמש כמערכת מודל לחקר קולטנים נוספים ממשפחת קולטנים מצומדי חלבון G, עליה הוא נמנה (באאוקריוטים).
הרודופסין ממוקם בקרומים פנימיים בתא הקנה, בעלי מבנה של דסקיות הערומות באופן צפוף זו על זו (כ-2000 דסקיות בכל תא). הרודופסין בנוי משני מרכיבים: מפפטיד בן 348 חומצות אמינו בשם סקוטופסין (Scotopsin) וממולקולת רטינל, נגזרת אלדהידית של ויטמין A, המשמשת ככרומופור[3]. החלבון סקוטופסין שייך למשפחת קולטנים מצומדי חלבון G, אשר מפעילים מסלולי בקרה תוך תאיים בתגובה לאותות חיצוניים. הפעלה של חלבונים במשפחה זו על ידי אות חיצוני גורמת לשינוי מבני בצד התוך תאי של הקולטן ומאפשרת קשירה והפעלה של חלבון G מתאים. האותות החיצוניים מגוונים ויכולים להיות יונים, חומצות גרעין, פפטידים, הורמונים ומולקולות טעם וריח ועוד. במקרה של הרודופסין האות הוא אור הנקלט ברטינל, ומאפשר את תחילתו של תהליך הראייה. בדומה לכלל החלבונים במשפחת הקולטנים המצומדים לחלבון G, הסקוטופסין, המרכיב החלבוני של הרודופסין, מכיל שבעה סלילי אלפא חוצי-ממברנה, שלוש לולאות בצד התוך-תאי ושלוש לולאות בצד החוץ-תאי. כך שניתן לחלק את הסקוטופסין לשלושה אזורים מבחינת יחסי תפקוד-מבנה: האזור התוך-תאי/ציטוסולי (קצה קרבוקסילי), האזור החוץ-תאי (קצה אמיני) וביניהם האזור הקרומי.
האזור התוך-תאי מאופיין, בנוסף לשלוש הלולאות שבו, בסליל אלפא שמיני קצר, סמוך לזנב הקרבוקסילי, בעל אופי אמפיפילי. צירו של סליל האלפא השמיני כמעט מקביל לקרום והוא קבור בו בחלקו. בנוסף הוא מעוגן לקרום בקצהו על ידי קשירתן של שתי קבוצות פאלמיתוייל (palmitoyl) לציסטאינים 322 ו-323 באופן המבטיח את סמיכותו של הסליל לקרום. סליל 8 מפגין שמירות אבולוציונית ונראה כי יש לו תפקיד, יחד עם הלולאות הפנימיות 2 ו-3, בקשירתו של טרנסדיוצין בשלב ה-מטא2.
האזור החוץ-תאי של הסקוטופסין חשוב לקיפול נכון של החלבון, לעיבודו הנכון בתא ולתעבורתו בתא אל ממברנות הדסקיות. בהתאם לכך מוטציות בלולאות החוץ התאיות גורמות להיתקעות של הסקוטופסין ב-רטיקולום האנדופלזמטי, וליצירת תצמידים (קומפלקסים) של הסקוטופסין עם חלבונים סוככים. דוגמה לחשיבות של אזור זה ליציבות החלבון היא קשר דו-גופריתי (די-סולפידי) המקשר בין לולאה חיצונית 2 לסליל 3. קיומו של הקשר הדו-גופריתי חשוב בייצוב מבנה כיס-הקשירה של רטינל. מאפיין נוסף של אזור זה הוא סוכרים הקשורים בזנב האמינו של החלבון על אספרגינים 2 ו-15 ברצף החלבון ודרושים להפעלה תקינה של טרנסדיוצין בתגובה לאור.
האזור הקרומי מכיל את הכיס הקושר את הרטינל. באזור זה אינטראקציות רבות המייצבות את מצב היסוד של הרודופסין ומאפשרות לו בכך יציבות גבוהה בחשכה. ארבע רשתות של קשרי מימן מקשרות בין הסלילים השונים באזור זה. בקרבת אזור המגע עם הציטוזול, בקצהו הקרבוקסילי של סליל 3 (שיירים 106 עד 139), מצוי מוטיב ה-E(D)RY (שיירים 134 עד 136). זהו מוטיב נפוץ מאוד בקולטנים מצומדי חלבון G (אם כי בדרך-כלל הרצף הוא DRY) ובעל תפקיד בבקרת הקשר עם חלבון ה-G. במצב הלא פעיל של רודופסין מוטיב זה נמצא באינטראקציה יונית עם גלוטמט 247. קשר יוני זה נשבר בשלב שפעול החלבון כתוצאה מאיזומריזצית הרטינל הגורמת לתזוזת סליל 6. תזוזה זו חושפת את המוטיב לציטוזול ומאפשרת לו להגיב עם חלבון ה-G.
סליל מרכזי נוסף הוא סליל 7 אשר מכיל את ליזין 296, השייר היוצר את בסיס השייף עם הרטינל. הקצה הקרבוקסילי של סליל 7 מכיל את מוטיב ה-NPXXY, אשר אופייני גם הוא בקולטנים מצומדי חלבון G. מוטיב זה יוצר מספר אינטראקציות עם סליל 2 ועל כן חשוב ביציבות המבנה של הקולטן.
מוטציות ברצף של גן הסקוטופסין גורמות בדרך כלל לניוון ראייתי חמור דומיננטי ואוטוזומלי בשם רטיניטיס פיגמנטוזה. לעומת זאת מוטציות המוחקות לחלוטין את הגן או מונעות מהגן להיות משועתק או מתורגם לחלבון גורמות רק לפנוטיפ רצסיבי של המחלה. בעוד, בהטרוזיגוטים למוטציות כאלו ניכרת רק ירידה חלקית בתפקוד הראייה. עובדות אלו מדגימות את החשיבות של כמות הפיגמנטים בתא הקנה והחיוניות של תפקודם התקין של כלל הקולטנים.
הפוטון הנקלט ברטינל גורם לסדרה של שינויים מבניים ברודופסין. שינויים מבנים אלו גורמים להפעלת חלבון G בשם טרנסדיוצין (transducin) או Gt. תהליך זה ידוע כ"תהליך ההלבנה", מכיוון שרודופסין מאבד את צבעו במהלכו. זהו תהליך מהיר ומרגע עירור הכרומופור על ידי פוטון ועד להפעלת הרודופסין משך הזמן הוא מסדר הגודל של מילישניות בודדות[4].
מערכת הרודופסין נוחה להפעלה מלאכותית ומדויקת באמצעות אור ולכן אפיון פיזיקלי של תפקודה במימד הזמן הוא נוח, כמו כן תהליך הבידוד של הרודופסין בכמויות גדולות מרשתיות של בקר הוא פשוט. על-כן מערכת זו הפכה למערכת מודל נוחה בפענוח מנגנון הראייה בפרט ופעילות קולטנים מצומדי חלבוני G בכלל. הבנה מעמיקה של התנהגות הכרומופור והשפעתו המבנית והאנרגטית על רודופסין בכללו, היא צעד מפתח בכך.
הרודופסין נחקר במגוון שיטות ספקטרליות, גנטיות, ביוכימיות ואף נקבע מבנהו התלת-ממדי בעזרת התאבכות קרני רנטגן[5].
טרנסדיוצין הוא חלבון ה-G המצומד לרודופסין. טרנסדיוצין הוא בעל שלוש תת-יחידות: α, β ו-γ. לאחר הפעלת הרודופסין מתבצעת החלפה של GDP ל-GTP ביחידת האלפא של טרנסדיוצין. החלפה זו מפעילה את טרנסדיוצין, אשר מפעיל את cGMP-phosphodiesterase. הפעלה זו גורמת לירידה בריכוז ה-cGMP בתא. הירידה בריכוז ה-cGMP גורמת לסגירת תעלות יונים תלויות cGMP ובכך לקיטוב של התא, אשר גורם ליצירת פוטנציאל פעולה בתא ולהפעלת הסינפסה.
קיים מנגנון "כיבוי" למצב-הפעיל ברודופסין. לאחר הפעלת הרודופסין מתבצע בו זירחון בשלוש עמדות סרין (334, 338, 343) על ידי חלבון בשם רודופסין-קינאז (Rhodopsin-Kinase). אל הרודופסין המזורחן נקשר החלבון ארסטין (arrestin), אשר "מכבה" את הרודופסין הפעיל. ארסטין נקשר בספציפיות ובמהירות גבוהה ובכך גורם לדעיכה מהירה של האות.
פוטופסינים
עריכהכל האופסינים מכילים קבוצה פונקציונלית בשם רטינל, המשנה את סידורה המרחבי כאשר היא בולעת פוטון בודד של אור. מידת הרגישות של הקולטן לתדרים אלקטרומגנטיים שונים מושפעת על ידי החלבון הקשור לרטינל. רגישות הרודופסין היא מרבית עבור פוטונים באורך גל 498 ננומטר. הפוטופסינים, המצויים בתאי מדוכים, מורכבים משייר חלבוני הנבדל בחומצות אמינו בודדות מהסקוטופסין המרכיב את קולטן הרודופסין. רשתיותיהם של מרבית בני האדם מכילות שלושה פוטופסינים שונים שרגישותם מרבית לאורכי הגל 420, 534 ו-564 ננומטרים. המדוכים המכילים פוטופסינים אלה מכונים מדוכים רגישי אורך-גל קצר (Short Wavelength Sensitive, בקיצור SWS או S), בינוני (M) וארוך (L). כפי שניתן ללמוד מן האיור, עקומי ההיענות של צבעני M ו-L (העקומים הירוק והאדום) דומים למדי. מקצת הנשים מבטאות סוג רביעי של צבען ברשתיותיהן, הנבדל מצבען L בחומצת אמינו יחידה. בגן המקודד פוטופסין רביעי זה התחלף הקודון TCT, המקודד לסרין, ב-GCT המקודד לאלנין. שינוי זה גורם להזחה צנועה של 3–4 ננומטרים בעקום ההיענות של הצבען הרביעי. בניסויים נמצא כי תפיסת הצבע של נשים אלו עשירה מזו של נשים וגברים אחרים.[6][7] גברים, מנגד, מועדים יותר ללקות בעיוורון צבעים מסוגים מגוונים, היות שהם נושאים העתק יחיד של כרומוזום X, ורבים מהגנים הקשורים בראיית צבעים מצויים על כרומוזום זה. אם כי זה כולל גם דלתוניזם (הסוג הנפוץ ביותר של עיוורון הצבעים באדם), שאינו קשור לביטוי פוטופסינים ברשתית, אלא לעיבוד הראשוני של מידע הצבע, בגנגליוני תאי העצב, ברשתית.
לאור הדמיון התורשתי בין הפוטופסינים השונים לבין הרודופסין, היה זה אך טבעי לשער כי מקורם של הפוטופסינים במוטנטים של רודופסין שהתפלגו ממנו במהלך ההתפתחות האבולוציונית של בעלי חוליות. מנגד הציע גורדון וולס (Gordon Lynn Walls) בשנת 1942 כי תאי הקנים בעלי הרודופסין הם שהתפתחו מהמדוכים, לצורך שיפור רגישותם לאור קלוש.[8] השערה זו, שנשענה על מחקריו על רשתית דג הלאמפרי (Pouched lamprey, חסר לסתות ממשפחת הצמדיים [1]), נתקלה בספקנות מצד הקהילה המדעית. [9] במפתיע, העלה חקר הקירבה התורשתית בין בעלי חוליות שונים ממצאים התומכים בהשערתו של וולס. נמצא כי עוד בעידן הקמבריון לפני 540 מיליון שנים בוטאו 4 פוטופסינים שונים בבעלי חוליות, בטרם התפצלו אלה לחולייתנים לסתניים ולחסרי לסתות. פוטופסינים קדומים אלה הסתעפו לשש קבוצות המכילות למעלה מאלף מינים של אופסינים, בהם הרודופסין המצוי בתאי קנים אנושיים[1]. בעלי החוליות של ימינו מבטאים חמישה גנים שונים של אופסינים ברשתיותיהם, המקודדים לקולטנים הפורשים את מקטע הספקטרום האלקטרומגנטי לו רגיש היצור[9]. חלקם מבטאים יותר מצבען אחד באותו תא קולט אור[9].
שלושת סוגי המדוכים ברשתית האנושית מפוזרים באופן אקראי לכאורה ברחבי הרשתית. מספר המדוכים מסוג M ו-L במרכז הרשתית משתנה באופן ניכר מאדם לאדם[7] וניתן לשער כי גם תפיסת הצבע משתנה מאדם לאדם. מכיוון שמדוכים שונים מגיבים במידה שונה לפוטונים באורך גל נתון, ניתן להבחין בין שטף האור לבין אורך הגל שלו על ידי השוואת תפוקותיהם של מדוכים מסוגים שונים.
בדומה לרודופסין קיים מגוון רחב של צבענים במשפחת האופסינים, בעלי רגישות לתחומים שונים של הספקטרום האלקטרומגנטי, לרבות אורכי גל בתחום העל סגול והתת אדום שהעין האנושית אינה רגישה להם. קיים דמיון מבני ותורשתי רב בין האופסינים השונים. הכרומופור בכל האופסינים הוא נגזרת אלדהידית של ויטמין A, לכן מחסור בוויטמין A עלול לגרום לעיוורון[10].
מלאנופסין
עריכהמלאנופסין הוא סוג של אופסין הנמצא בתאי גנגליון קולטי אור ברשתית של בעלי חוליות. מלאנופסין מעורב בקביעת המקצב היממי של השעון הביולוגי בהתאם לרמות התאורה השוררות בסביבה, בשליטה ברפלקס האישון ובתגובות אחרות של הגוף לאור. מלאנופסין נבדל מאופסינים אחרים בבעלי חוליות וניכר בו דמיון רב דווקא לאופסינים בחסרי חוליות, הן ברצף חומצות האמינו המרכיבות אותו והן בשרשרת הולכת האותות הקשורה לפעולתו.
רטינל
עריכההרטינל היא מולקולה ממשפחת הקרטינואידים הנוצרת מחמצון של ויטמין A. היא בעלת מערכת מצומדת של קשרים כפולים הגורמת לבליעת אור בתדרי אור נראה. תחום אורכי הגל הנבלעים תלוי בסביבה הכימית הנוצרת בפנים החלבון, ולכן הומולוגים של הרודופסין בולעים בטווח צבעים שונה. בליעה של פוטון גורמת לעירור של הרטינל ולאיזומריזציה של הקשר הכפול בין פחמנים 11 ו-12 מציס לטרנס. שינוי קונפיגורציה זה גורם לשינויים אלוסטריים בחלבון ובכך להפעלת הרודופסין[11].
הרטינל קשור קוולנטית לסקוטופסין באמצעות בסיס שיף הנוצר עם שייר ליזין 296 השמור אבולוציונית. שייר זה ממוקם בחלק הקרומי של הקולטן על סליל האלפא השביעי. בסיס השייף קשור לפרוטון, ועל מנת לייצב את המטען החיובי של הפרוטון, נמצא בסמוך לו שייר קרבוקסילי טעון שלילית, של שייר גלוטמט 113, השמור אבולוציונית אף הוא. הטבעת ההידרופובית של הרטינל יוצרת אינטראקציה עם כיס הידרופובי פנימי ברודופסין. משמע, הרטינל מקובע בשלושה סוגי קשרים שונים לאופסין ומשני קצותיו. אופן קשירה זה מאפשר לרטינל לגרום לשינויים אלוסטריים מקיפים ברודופסין בעת האיזומריזציה.
תהליך שפעול הרודופסין ניתן לחלוקה למספר תהליכי-ביניים. ה"תהליך הראשוני" מוגדר כמעבר ממצב מעורר ראשוני, גבוה אנרגטית, חומר-ביניים אנרגטי נמוך יותר, הנקרא "באתו-רודופסין" (Batho-Rhodopsin). התהליך הראשוני מאופיין בהסטה לאדום של אזור מקסימום הבליעה ל-543 ננומטר. האיזומריזציה של מלקולת הרטינל מתרחשת לאחר כ-200 פמטושניות מרגע קליטת הפוטון ומיד לאחר מכן נוצר חומר-הביניים באתו. בתהליך הראשוני נקבעת הניצולת הקוונטית של בליעת הפוטון, ועל כן הבנתו היא מרכזית בחקר הרודופסין.
המהירות הכבירה של תהליך זה אפשרית בשל הסביבה הכימית הייחודית השוררת בתוך הרודופסין, והיא מהתגובות המהירות ביותר הידועות בכימיה. האיזומריזציה מהירה מכדי לאפשר שינוי משמעותי בסידור המרחבי של מולקולת הסקוטופסין, לכן האיזומריזציה כולה מתרחשת בתוך אתר הקשירה המקורי של הציס-רטינל. מנגנון זה מאפשר שימור מרבית האנרגיה של הפוטון (נצילות אנרגיה של כ-67%). אנרגיה זו משתחררת על ידי הרפיית המתח הסטרי באמצעות שינויי הדרגתיים במבנה המרחבי, במספר שלבי ביניים (לומי ומטא1). זאת עד להגעה למצב הפעיל של הקולטן, מטא2.
בסופו של תהליך ההלבנה משתחררת אנרגיית הפוטון כולה והטרנס-רטינל מתנתק מהחלבון. כמו כן חשוב לציין את אנרגיית השפעול הגבוהה למעבר ממטא1 למצב הפעיל, מטא2. אנרגיית שפעול גבוהה זו מגדילה את האדישות הכימית הכמעט-מוחלטת של הרודופסין בחשכה מכיוון שהיא גבוהה בהרבה מהאנרגיה התרמית של הסביבה לפי התפלגות בולצמן. מנגנון זה הוא דוגמה מצוינת לאיזון התרמודינמי והקינטי העדין הקיים במערכות ביולוגיות. הנצילות הגבוהה של הקולטן יחד עם אנרגיית השפעול הגבוהה של חומר-הביניים הפעיל נחוצה להגדלת יחס אות לרעש של המערכת. כל זאת בנוסף לרגישות של מערכת זו, עד כדי כך שבתנאים מיטביים הקולטן מסוגל להגיב גם להגעת פוטון בודד.
קישורים חיצוניים
עריכההערות שוליים
עריכה- ^ 1 2 Akihisa Terakita, The opsins, Genome Biol. 2005;6(3):213 PMID 15774036
- ^ Nayak SK, Jegla T, Panda S., Role of a novel photopigment, melanopsin, in behavioral adaptation to light, Cell Mol Life Sci. 2007 Jan;64(2):144-54 PMID 17160354
- ^ Filipek, S., Stenkamp, R.E., Teller, D.C., and Palczewski, K. (2003). G PROTEIN-COUPLED RECEPTOR RHODOPSIN: A Prospectus. Ann. Rev. Phys. 65, 851–79.
- ^ Ohguro, H. (1996). Signal transduction mechanism in photoreceptor cells. Sapp. Med. J. 65(1), 65-72
- ^ Palczewski, K., Kumasaka, T., Hori, T., Behnke, C.A., Motoshima, H. Fox, B.A., Trong, I.L., Teller, D.C., Okada, T., Stenkamp, R.E., Yamamoto, M., and Miyano, M. (2000). Crystal Structure of Rhodopsin: A G Protein–Coupled Receptor. Science. 289, 739-745.
- ^ Jameson KA, Highnote SM, Wasserman LM., Richer color experience in observers with multiple photopigment opsin genes, Psychon Bull Rev. 2001 Jun;8(2):244-61., PMID 11495112
- ^ 1 2 Samir S Deeb, Genetics of variation in human color vision and the retinal cone mosaic, Curr Opin Genet Dev. 2006 Jun;16(3):301-7. PMID 16647849
- ^ Gordon Lynn Walls, The vertebrate eye and its adaptive radiation, Cranbrook Press, Bloomfield Hills, Michigan, 1942, 14 + 785 pp.
- ^ 1 2 3 Collin SP, Trezise AE, The origins of colour vision in vertebrates, Clin Exp Optom. 2004 Jul;87(4-5):217-23. PMID 15312025
- ^ Wolf, G. (2001). The Discovery of the Visual Function of Vitamin A. Journal of Nutrition. 131,1647-1650
- ^ Vershinin, A. (1999). Biological functions of carotenoids-diversity and evolution. BioFactors. 10, 99-104.