מחלת השינה
| יש לערוך ערך זה. הסיבה היא: חסר מידע חשוב על תקופת הדגירה, אי דיוקים בהתפתחות המחלה. | |
מחלת השינה (שם מדעי: טריפנוזומיאזיס אפריקני, Trypanosomiasis) היא מחלה זיהומית הנגרמת על ידי כמה מינים של הפרוטיסט Trypanosoma. ישנם שני מינים של פראזיטים הגורמים למחלה. trypanosoma brucei gambiense ו trypanosoma brucei rhodesinse. מחלת השינה קרובה למחלת צ'אגאס (Chagas), שנגרמת על ידי מין אחר של Trypanosoma ואשר מכונה טריפנוזומיאזיס אמריקני.
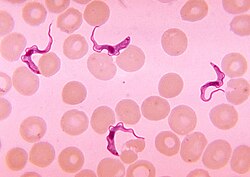 | |
| הפרוטיסט Trypanosoma במשטח דם | |
| תחום |
מחלות זיהומיות |
|---|---|
| גורם |
Trypanosoma brucei, Trypanosoma brucei gambiense, Trypanosoma brucei rhodesiense |
| תסמינים |
Winterbottom's sign, primary affect, סחרחורת, טכיקרדיה, נפיחות, cachexia, הפרעת שינה, אנמיה, periodic fever, כאבי מפרקים, כאב ראש, malaise, sopor |
| טיפול |
|
| קישורים ומאגרי מידע | |
| eMedicine | article/228613 |
| DiseasesDB | 29277 |
| MeSH | D014353 |
| MedlinePlus | 001362 |
| סיווגים | |
| ICD-10 | B56 |
| ICD-11 |
1F51 |
הפרוטיסט הגורם למחלת השינה מועבר לבני אדם באמצעות זבוב הצֶה צֶה הנפוץ באפריקה. בארצות המערב מדובר במחלה נדירה, אך באפריקה חולים בה כל שנה כחצי מיליון איש ומתים ממנה כ-40,000.
הפרוטיסט
עריכההמצאות גאוגרפית בקו רוחב 15 מעלות צפונית ודרומית לקו המשווה. במרכז ומערב אפריקה T. bru gambiense ובמזרח אפריקה T.bru rhodesiense הפרזיט שטוח ודמוי כישור, בעל יכולת תנועה. בעל גרעין בודד, ה kynetoplast במרכז, שוטון בודד. כשהפרזיט אצל בני אדם - במצב של trypomastigot ה kynetoplast נמצא מאחורי הגרעין, בנקודת היציאה של השוטון. השוטון ממקום לארוך הקצה החופשי של הממברנה ובולט לפניה.
הדבקה
עריכההטפיל מועבר באמצעות זכרים או נקבות של זבובי צה-צה ממשפחת Glosinidae, במהלך הזנתם מדם הפונדקאי (פרסתן או אדם). הצורה המדבקת של הtrypomastigote נמצאת ברוק של הזבוב למשך 20 יום. אבל יכולת ההדבקה נשמרת לכל אורך חיי הזבוב, כמספר חודשים.
תסמינים
עריכהT. br. gambiense מסתגל טוב יותר לאדם והמחלה היא בדרך כלל סאב אקוטית או כרונית. לעומתו T. br. rhodesiense גורם למחלה חריפה המתפתחת תוך מספר חודשים. תקופת הדגירה היא של 5-20 יום.
- שלב מוקדם נמשך מספר חודשים עד שנתיים.
- כ 5 ימים לאחר הנשיכה יופיע כיב (אנ') אופייני על העור. הכיב יגדל בשבועות הבאים ועלול לגרום לנפיחות בבלוטות הלימפה הקרובות למקום הנשיכה.
- hematogenous phase (שלב דמי)
- חום מופיע בשלב מוקדם, לעיתים מלווה בכאב ראש ובבצקת מקומית של העור.
- בהמשך פריחה בעור מלווה בגרד ונוצרת כתוצאה מהתגובה החיסונית. ישנה התעבות של עור הפנים האופיינית למחלה, לעיתים מלווה בשינויים משמעותיים בפנים.
- הגדלה של בלוטות הלימפה. הבלוטות יהיו סימטריות ללא מוגלה, ולא כואבות במיוחד. בדרך כלל יעורבו בלוטות הצוואר ובלוטות העורף. במקרה של T.br. rhodesiense תהיה מעורבות של בלוטות השחי והמרפק.
- הגדלה של הטחול
- צהבת, מלווה באנמיה קלה נפוץ יותר ב T.br. rhodesiense
- תפליט פלאורלי ופריקרדילי הם נפוצים, לעיתים יופיעו גם דלקת בשריר הלב.
- הפחתה במתן שתן, עקרות והפלות
סימנים נוירולוגיים בשלב המקודם:
- התכווצות שרירים בלילה ועור רגיש במיוחד. הסימנים הנורולוגיים מבשרים את המעבר לשלב הבא.
- במקרים נדירים בעיקר ב T.br. rhodesiense יתרחש זיהום נרחב בשלב זה והחולה ימות עוד לפני מעורבות של המוח האופיינית לשלב המאוחר של המחלה.
שלב מאוחר
- שינויים קוגניטיביים: אלימות, הזיות, סימנים הדומים לסכיזופרניה.
- הפרעות שינה: שינה מופחתת בלילה, הרדמות במהלך היום עם התקדמות המחלה יהיה קשה להעיר את החולה. ובשלב מסוים הוא יישן כל היום, עלול להירדם תוך כדי אכילה.
- נוקשות בשרירים, תנועות עוויתיות פחות נפוצות.
- תגובה מאוחרת לכאב - Karandels sign
- הפרעות נוירו אנדוקריניות: עליה בחום הגוף, הפרעות בבלוטת התריס, עקרות וירידה בחשק המיני.
- מוות.
היסטוריה
עריכההמחלה נפוצה באפריקה לפחות מאז המאה ה-14 וסביר שהתקיימה שם גם אלפי שנים קודם לכן. המדען הגרמני פאול ארליך[1] פיתח את התרופה הכימית אטוקסיל אשר הייתה יעילה נגד הפרוטיסט אך התעוורות הייתה אחת מתופעות הלוואי. מאז פותחו מספר תרופות שונות לטיפול במחלה.
המחלה מופיעה באופן קבוע באזורים מסוימים באפריקה שמדרום לסהרה, עם אוכלוסייה בסיכון המונה כ-70 מיליון איש ב-36 מדינות.[2] מאז 2010 גרמה המחלה לכ-9,000 מקרי מוות, לעומת 34,000 בשנת 1990.[3] לפי ההערכות כ-30,000 איש חולים במחלה כיום, מתוכם 7,000 מקרים חדשים נוספו בשנת 2012.[4] מעל 80% מהמקרים הם ברפובליקה הדמוקרטית של קונגו.[4] בהיסטוריה המודרנית נרשמו שלוש התפרצויות עיקריות של המחלה: האחת בין השנים 1896 ו-1906 בעיקר באוגנדה ובאגן קונגו ושתיים נוספות ב-1920 ו-1970 במספר מדינות אפריקניות.[4] בעלי חיים אחרים כגון פרות, עלולים לשאת את המחלה וגם להידבק בה.[4]
אבחנה
עריכהתחת מיקרוסקופ בצביעת גימזה. את הדגימה ניתן לקחת מהבלוטות, ממח העצם, מנוזל המוח או מהכיבים ניתן לבצע בדיקה אימנולוגית - ELISA, IFAT. CATT כאשר CATT(card agglutination test for trypanosomes) זאת בדיקת הבחירה ל T..br רמות גבוהות של IgM יישארו כל זמן שהזיהום יהיה אקטיבי.
אבחנה מבדלת
עריכהבשלב המוקדם הפטיטיס ויראלי מלריה tryphoid.
בשלב המוקדם בו יש סימנים נוספים לחום. kala azar TB brucellosis לימפומה.
בשלב המאוחר כאשר יש מעורבות של הצרברום. סיפליס גידולים cerbral TB chronic viral encephalitis.
טיפול
עריכהסוראמין ו pentamidine בשלב המוקדם. melarsoprol בשלב המאוחר. נגד המחלה קיימות מספר תרופות יעילות [דרוש מקור], אם כי לכולן תופעות לוואי חמורות, וחלקן אף עלולות להיות קטלניות. אלו, בשילוב עם מחירן הגבוה של התרופות ועם חוסר העניין של חברות התרופות בהשקעת משאבים רבים בפיתוח תרופות נגד המחלה, אשר כאמור אינה נפוצה במערב, אחראיות לשיעורי ההדבקה והמוות הגבוהים באפריקה אף כיום. התרופה היעילה ביותר נגד מחלת השינה Efornithine פותחה בשנות ה-70. תרופה אחרת - סוראמין - פותחה עוד ב-1916 בגרמניה.
מחקרים
עריכה- במחקר מ-2018 (בו השתתף חוקר מהטכניון) שצוטט בכתב העת המדעי Nature, גילו החוקרים קשר ייחודי בין ארגונו המרחבי של הגנום לבין מנגנון החלפת האנטיגן – החלבון שאותו מזהה מערכת החיסון האנושית. מנגנון החלפת האנטיגן מאפשר ל- Trypanosoma brucei לחמוק ממערכת החיסון של האדם הנגוע. להערכת החוקרים, ייתכן שתגלית זו תאפשר בעתיד לפתח טיפולים שיגנו על האוכלוסייה המועדת להידבקות.[5][6]
קישורים חיצוניים
עריכההערות שוליים
עריכה- ^ Bauman, R. W. "Microbiology". Pearson Education, San Francisco: 2006
- ^ Simarro PP, Cecchi G, Franco JR, Paone M, Diarra A, Ruiz-Postigo JA, Fèvre EM, Mattioli RC, Jannin JG (2012). "Estimating and Mapping the Population at Risk of Sleeping Sickness". PLoS Negl Trop Dis. 6 (10): e1859. doi:10.1371/journal.pntd.0001859.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ Lozano, R (15 דצמ' 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
{{cite journal}}: (עזרה) - ^ 1 2 3 4 WHO Media centre (במרץ 2014). "Fact sheet N°259: Trypanosomiasis, Human African (sleeping sickness)". World Health Organization. נבדק ב-25 באפריל 2014.
{{cite journal}}: (עזרה) - ^ פוצח מבנה הגנום של טפיל השינה הקטלני | Technion - Israel Institute of Technology
- ^ T. Nicolai Siegel, Robert P. Sebra, Antoine-Emmanuel Saliba, Thomas D. Otto, Genome organization and DNA accessibility control antigenic variation in trypanosomes, Nature 563, 2018-11, עמ' 121–125 doi: 10.1038/s41586-018-0619-8
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.